作者:Gyohei Egawa a,Kenji Kabashima
原文:Barrier dysfunction in the skin allergy
皮肤覆盖了我们整个身体,保护我们免受各种外界刺激。屏障受损会导致外部抗原的渗透加强,也容易诱发皮肤炎症。外部抗原和局部免疫细胞相互作用的加强,可能会导致全身免疫反应。这是“从内到外的假设”,它解释了皮肤屏障功能障碍与过敏性疾病风险增加之间的关联,包括特应性皮炎(AD),哮喘,食物过敏和过敏性鼻炎。
另外,显而易见的是,持续性的皮肤炎症反过来也会导致皮肤屏障功能进一步衰弱。如此下去便在皮肤屏障和皮肤免疫力之间导致了“恶性循环”。因此维持皮肤屏障不仅是对过敏性疾病的有效控制,也是防止其进一步发展的重要因素。
皮肤屏障功能很大程度上取决于皮肤角质层(SC),也就是皮肤最外层。SC是通过角质形成细胞严格的分化调节,最后角质化形成的。角质化的过程穿透了表皮的四个细胞层:角质化基底层、棘层、颗粒层(SG)到SC。
在SG中,角质形成细胞最先开始产生两个膜-外层链接颗粒:角质透明颗粒和层状体(图1B)。角质透明颗粒含有SC的细胞内成分(如丝聚蛋白[FLG],氯霉素和角蛋白丝),而层状体含有细胞外成分(如脂质,角质素和激肽释放酶)。
在SC中,角质形成细胞变平并脱掉细胞核(然后称为角质细胞),同时,角质细胞细胞膜被一个称为角质化包膜(CE)的特定屏障结构所取代。在从SG到SC的过渡中,层状体分泌到角质细胞的细胞间隙中并用脂质填充它。这些结构通常被描述为砖(角质细胞)和灰浆(细胞间脂质)结构。
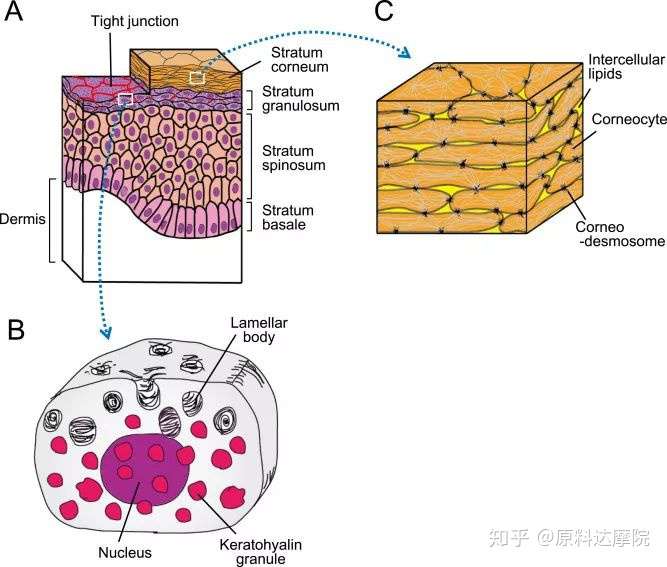
图1. A,表皮的结构,红线代表颗粒层中的紧密连接。B,颗粒层中细胞的放大视图。C,角质层的“砖和墙”结构。
现在我们通过五个方面描述SC屏障的形成以及其对皮肤过敏性疾病发病机理的影响:1、丝聚蛋白代谢;2、角质化包膜;3、细胞间脂质;4、角膜基质;5、角质细胞脱落。
丝聚蛋白(FLG)代谢
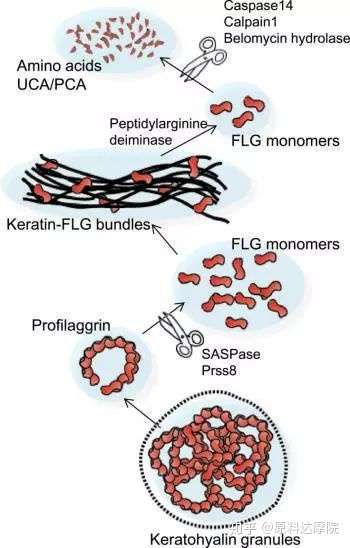
图2. FLG代谢过程的模式。在颗粒层中,丝聚蛋白酶储存在角质透明颗粒中,然后裂解成FLG单体。FLG单体与角质细胞中的角蛋白丝结合。在SC的上层,FLG单体从角蛋白释放并裂解成游离氨基酸,然后转化成PCA和UCA。
FLG及其代谢产物是维持皮肤屏障功能的关键组分。在SG中,FLG以聚合物形式构成,含有10~12个重复单体相互联系,并储存在透明的角质颗粒中。在SG到SC的演变过程中,聚蛋白聚糖被蛋白酶(如:CAP1/Prss8和SASPase/ASPRV1)切割产生FLG单体。FLG单体结合角蛋白丝形成FLG-角蛋白束,这是角质细胞中的基本结构。
在上层的SC中,进一步代谢会使FLG和角蛋白丝相互分离,这个过程中,肽酰精氨酸脱亚胺酶对FLG和角蛋白-1进行酸化。被释放而出的FLG会变成游离氨基酸,如谷氨酰胺、精氨酸和组氨酸。然后再被转化成为尿酸(UCA)和比诺烷酮羧酸(PCA),该过程中有caspase14,calpain1和博来素水解酶。尿酸是角质层中重要的紫外吸收成分,并且对皮肤酸性环境起着重要影响。
最近有研究表明,尿酸能够降低树突上共刺激性分子的表达,增加他们在调节效应T细胞的能力。而PCA是天然保湿因子,能保住SC上的水分。因此,FLG在及其代谢产物均对SC的屏障功能起着多方面作用。基因靶向研究表明,缺乏FLG的小鼠表现出降低SC的屏障作用,致敏性也大大增强。在BALB/c小鼠过敏背景下,FLG缺陷会导致小鼠自发发生炎症。
FLG不足引起的皮肤过敏
特异性皮炎(AD)是最常见的炎性皮肤病,且具有多种病因。在过去的十多年中,众多实验及临床数据表明,皮肤屏障缺乏是AD的主要病因。FLG基因功能性丧失、突变和AD的恶化与寻常鱼鳞病具有较强相关性。在北欧和亚洲人群,特异性皮炎患者中发生FLG突变的人数占达25%~50%。在欧洲、非洲、日本和拉美裔血统的个人之间进行全基因组关联,分析AD的31个风险项。其中FLG的突变是最强的风险因素。这些研究均表明FLG的缺乏是AD的主要致病因素。
在北欧和亚洲群体中,FLG突变非常常见,但是在南欧却较少见,甚至一些非洲国家都不会发生。最近的研究表明,另一种皮肤屏障蛋白,FLG2,在AD患者的上皮中也呈减少趋势。此外,在非洲血统的AD患者中没有FLG2基因的突变现象,FLG2的生物学功能还需要进一步阐明,但是其结构、表达模式和生理学特征和FLG非常相似。因此FLG2在皮肤屏障的完整性上也发挥着重要作用。我们还应该指出这种可能性,就是在热带气候下FLG的缺乏是可以弥补的。
角质化包膜的形成
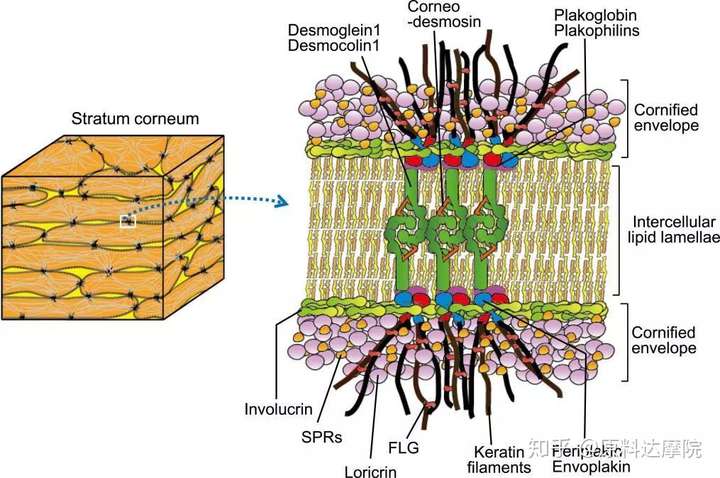
图3. 角质化的包膜和角质细胞间桥粒的结构。内披蛋白形成支架并由兜甲蛋白和SRR 增强。桥粒蛋白-旁血小板溶蛋白 异二聚体缀合角蛋白丝
角质化包膜CE,是角质细胞细胞膜形成的特定结构。高度交联的不溶性蛋白和细胞外基质锚定在上面。这种结构是SC的重要物理屏障。CE在棘层上层开始组装合成,随细胞间Ca2+水平增加而增加,角质形成细胞产生桥粒蛋白、旁血小板溶蛋白和内披蛋白。桥粒蛋白和旁血小板溶蛋白形成二聚体,再和内披蛋白一起在脂质膜下累积。这三种蛋白以转谷酰胺酶TG1和TG5相互交联在一起。内披蛋白充当CE的支架,而二聚体结构充当角蛋白丝的结合位点并将它们与桥粒蛋白结合。重要的是,内披蛋白支架和血小板溶素蛋白紧密相连,桥粒和角蛋白细丝刚性连接,这赋予了角质细胞机械稳定性。
在SC中,氯霉素和小分子连接蛋白系列被产生。这些蛋白通过TG3交联并且转运到细胞周围,之后他们会通过TG1和TG5在预先存在的内披蛋白的支架上交联。为了加固CE,反复的交联最后80%的CE蛋白以兜甲蛋白构成。TG1还将细胞外的神经酰胺脂质结构结合到内披蛋白的支架上,这样最终神经酰胺取代脂质膜的双层结构。该步骤进一步描述了“细胞间脂质薄片的形成”。
过敏性皮肤的角质化包膜
尽管CE中广泛存在桥粒蛋白、旁血小板溶蛋白和内披蛋白,但是在小鼠上进行这些基因的单基因敲除并没有表现出任何的皮肤异常。三次敲除这三个基因会导致CE的形成异常,如脂质成分降低以及机械完整性减弱,但是皮肤屏障功能是正常的(可能通过减少补偿脱屑角质细胞)。类似的,兜甲蛋白缺陷型的小鼠显示一个微妙的表现形态,出生时皮肤光泽,CE的稳定性降低。这些研究表明,CE蛋白应该是多余的,具有代偿机制的存在。按照这个概念,目前尚未发现CE组分基因突变与皮肤过敏性疾病的发病机制有关联。
CE发生异常或者是TG1的缺失,会导致严重的鱼鳞状红皮病(常染色体隐性遗传的先天性鱼鳞病 [ARCI] 1)发生。
此外,TG5的缺乏会导致皮肤脱皮综合征2,就是在SG和SC交界处会发生浅表性的皮肤剥离现象。
细胞间脂质薄片的形成
细胞间脂质也是SC屏障的组成部分,由神经酰胺,游离脂肪酸和胆固醇的非均匀混合物组成,比例约为1:1:1。这些脂质在SG中产生并储存在层状体中,之后向SC过渡时被分泌到细胞外。仅在人SC屏障中的神经酰胺部分,就已鉴定出超过300种不同的物种。其中,Ω-hydroxyceramide是通过TG1支架和覆盖角质细胞形成偶联必不可少的成分,使用这种神经酰胺作为模板在角质细胞的细胞间隙中形成周期性的脂质薄片。
过敏皮肤的细胞间脂质薄片
神经酰胺加工酶出现一些缺陷时,发现其与屏障缺陷性皮肤病的病因有关。12R-脂氧合酶(在ALOX12B基因中编码)和表皮脂氧合酶-3(在ALOXE3基因中编码)都是产生ω-羟基神经酰胺的必需酶。这些蛋白质缺陷就会得先天性鱼鳞病(ARCI2或/和ARCI3)。皮肤缺乏ARCI2和ARCI3时比缺乏ARCI1表现得没有那么严重,可能是因为在这些疾病发生时形成了CE的蛋白质层。
层状体的跨膜转运是通过一种被称为ATP-binding cassette subfamily A member 12 (ABCA12)的脂质转运蛋白。该基因的突变导致温和的(ARCI4A)向重度(ARCI4B,也称为丑角鱼鳞病)先天性鱼鳞癣发生转变,其中板层小体含量在正常角质化中起重要作用。最近,跨膜蛋白79 / mattrin(Tmem79 / Matt)被证实会参与层状体内容物的分泌。TMEM79是位于板层小体的5-跨膜蛋白,TMEM79缺陷型小鼠表现出自发皮炎与血清的IgE升高的现象,这类似于人类AD的表现。此外,AD患者的目标分析表明,一个错误突变的 TMEM79基因与AD存在一个小而显著的关联。这些结果表明,所述板层小体功能和随后的细胞间脂质层错误结构的异常,可能会导致某些AD患者的屏障功能丧失。
未完待续...





 最新资讯
最新资讯
 鄂ICP备2022017323号
鄂ICP备2022017323号
 鄂公网安备 42018502006386
鄂公网安备 42018502006386

 发布展会
发布展会
 发布资讯
发布资讯



 你可能喜欢的主页
你可能喜欢的主页




 今日话题
今日话题



















